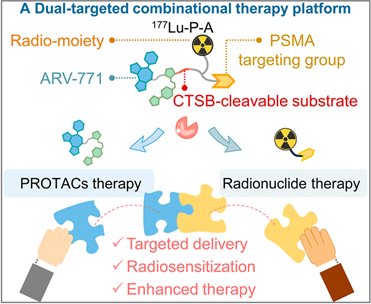
蛋白水解靶向嵌合體(PROTACs)是一種通過靶向蛋白質降解實現癌癥治療的前沿方法,但其目前仍存在較差的藥代動力學以及特異性不足等問題,進而會導致不良的脫靶效應和有限的抗腫瘤效力。有鑒于此,中國科學技術大學苗慶慶教授構建了雙靶向單分子治療探針(放射性177Lu-P-A及其冷對應物natLu-P-A),其可作為疾病激活的PROTACs,并且能夠結合靶向放射性核素治療(TRT),具有較高的特異性和有效性。
本文要點:
(1)該探針具有組織蛋白酶B(CTSB)激活的pro-PROTAC片段,可實現含溴結構域蛋白4(BRD4)的精準降解和靶向前列腺特異性膜抗原(PSMA)的177Lu基TRT。得益于良好的藥代動力學特性和PSMA介導的卓越靶向效率,該探針能夠表現出較高的腫瘤成像特異性和治療藥物的積累效率,以實現高效的PROTACs和TRT。研究發現,由于游離的PROTACs單元(如ARV-771)的靶向能力較差,因此其無法產生顯著的治療效果。
(2)與單一的治療方案相比,通過PROTAC激活實現的BRD4蛋白水解可以下調與放射敏感性相關的RAD51AP1表達,以協同增強TRT,促進聯合治療后的細胞凋亡。實驗結果表明,該探針也具有良好的腎臟清除效率,因此其在臨床轉化方面能夠表現出優異的生物安全性。綜上所述,該研究提出了一種利用精準PROTACs聯合TRT實現有效的腫瘤治療的新方法。
Yuan Zhang. et al. A Dual-Targeted Molecule for Disease-Activatable Proteolysis Targeting Chimeras and Targeted Radionuclide Therapy of Cancer. Journal of the American Chemical Society. 2025
DOI: 10.1021/jacs.4c18398
https://pubs.acs.org/doi/10.1021/jacs.4c18398



















