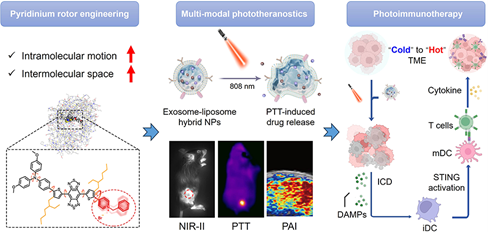
三陰性乳腺癌的免疫抑制性腫瘤微環境會阻礙免疫治療誘導的反應,導致抗腫瘤療效降低。盡管STING通路是一種有望能夠修復該缺陷的靶標,但不確定的藥物遞送往往也會導致脫靶炎癥反應。有鑒于此,廣西醫科大學寧峙彭教授、香港中文大學(深圳)唐本忠院士、廣州醫科大學張天富教授、新加坡國立大學陳小元院士和Kaiyuan Wang制備了一種具有聚集誘導發光特性的新型光學診療制劑,其可以引導STING激動劑的藥理激活,以實現光熱-免疫治療,產生免疫“熱”腫瘤。
本文要點:
(1)實驗設計了一種吡啶嗡轉子策略,并將其用于開發帶正電荷的TBTP-Bz。TBTP-Bz能夠與STING激動劑MSA-2被穩定地共結合到熱響應性外泌體-脂質體雜化納米顆粒中,以實現腫瘤靶向遞送。TBTP-Bz具有聚集增強的NIR-II發射和光聲信號,能夠實現實時的腫瘤示蹤。研究發現,光熱刺激可誘導免疫原性癌細胞死亡,并實現MSA-2的精準釋放,以促進STING激活和STING介導的I型干擾素的產生。
(2)實驗結果表明,單劑量光-免疫治療可以有效地抑制遠端腫瘤生長,并且能夠激發免疫記憶效應,以抑制術后復發和腫瘤再挑戰。綜上所述,該研究開發的新型光學診療藥物在免疫原性較差的乳腺癌臨床診療應用方面具有良好的潛力。
Shipeng Ning. et al. Pyridinium Rotor Strategy toward a Robust Photothermal Agent for STING Activation and Multimodal Image-Guided Immunotherapy for Triple-Negative Breast Cancer. Journal of the American Chemical Society. 2025
DOI: 10.1021/jacs.4c15534
https://pubs.acs.org/doi/10.1021/jacs.4c15534



















