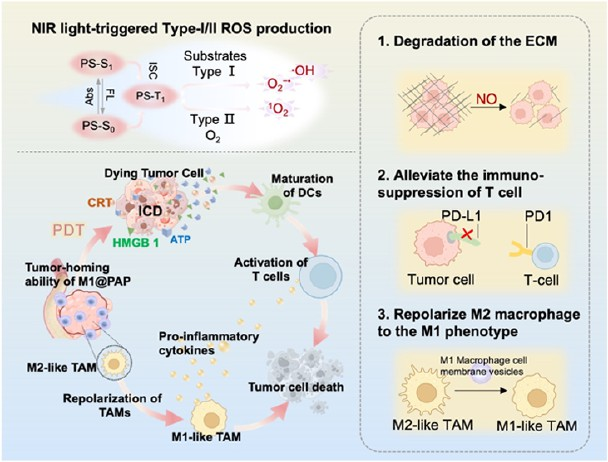
胰腺癌的治療仍面臨結締組織增生和嚴重乏氧等嚴峻挑戰。與依賴于氧氣的II型光敏劑不同的是,I型光敏劑即使在乏氧條件下也能產生大量的活性氧,因此其更加適用于胰腺癌光動力治療。然而,胰腺癌致密的細胞外基質會限制光敏劑的穿透效率,并且腫瘤微環境中存在的免疫抑制細胞也會導致治療效果降低。有鑒于此,北京大學梁曉龍研究員設計了由I型光敏劑和抗PD-L1 siRNA(siPD-L1)組成的光-免疫治療藥物M1@PAP納米顆粒,并將其包裹在M1巨噬細胞膜囊泡中。
本文要點:
(1)在該體系中,焦脫鎂葉綠酸-a(PPA)與聚精氨酸(Arg9)共價偶聯,其能夠在乏氧條件下產生大量的超氧陰離子,以發揮I型光敏劑的作用。此外,作為一氧化氮(NO)供體的Arg9也可通過抑制癌癥相關成纖維細胞(CAF)的激活和分解腫瘤細胞外基質提高納米光敏劑的穿透效率。
(2)M1巨噬細胞膜囊泡可提供主動靶向的能力和實現對免疫抑制性M2巨噬細胞的再教育。實驗結果表明,逆轉免疫抑制微環境可進一步促進基于抗PD-L1 siRNA的免疫治療的療效,進而能夠在乏氧胰腺腫瘤中實現高效的光動力-免疫協同治療。
Shuyu Xu. et al. Nitric Oxide-Producing Multiple Functional Nanoparticle Remodeling Tumor Microenvironment for Synergistic Photodynamic Immunotherapy against Hypoxic Tumor. ACS Nano. 2025
DOI: 10.1021/acsnano.4c16329
https://pubs.acs.org/doi/10.1021/acsnano.4c16329



















