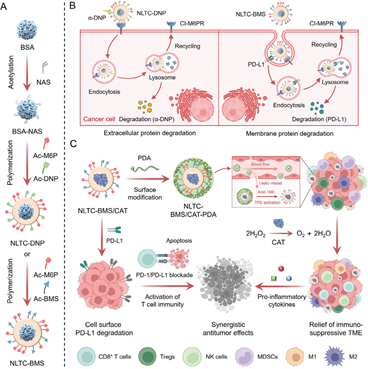
溶酶體靶向嵌合體(LYTACs)是一種通過劫持溶酶體靶向受體來降解細胞外和膜相關致病性蛋白的治療策略。然而,LYTAC的抗腫瘤作用仍會受到腫瘤積累不足和非特異性激活等問題的限制。此外,實現LYTACs和其它治療方式的協同作用對于增強療效至關重要。有鑒于此,安徽醫科大學Qi Liu和南開大學劉陽研究員開發了一種雙功能LYTAC納米平臺(NLTC),并將其用于實現腫瘤選擇性蛋白降解和增強癌癥免疫治療。
本文要點:
(1)研究者通過合理控制表面組成使得NLTC可以有效地將細胞外蛋白或膜蛋白通過不依賴陽離子的甘露糖6-磷酸受體轉運到溶酶體中進行降解。經過表面修飾后,實驗構建了能夠在腫瘤組織中有效積累的NLTC,其可以避免靶外腫瘤毒性。此外,NLTC的合成方法也普遍適用于多種酶。
(2)因此,研究者將過氧化氫酶(CAT)封裝在NLTC中,以協同降解癌細胞表面的程序性死亡配體-1(PD-L1)。實驗結果表明,該策略能夠緩解免疫抑制性腫瘤微環境,實現有效的癌癥免疫治療,顯著抑制B16F10荷瘤小鼠的腫瘤生長、復發和轉移。綜上所述,該研究工作構建了一種雙功能LYTAC納米平臺,其不僅可以進行組織選擇性蛋白質降解,還可以與其它治療方式相集成,有望為推動LYTAC技術的臨床應用提供新的見解。
Yumeng Xing. et al. A Bifunctional Lysosome-Targeting Chimera Nanoplatform for Tumor-Selective Protein Degradation and Enhanced Cancer Immunotherapy. Advanced Materials. 2025
DOI: 10.1002/adma.202417942
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202417942



















