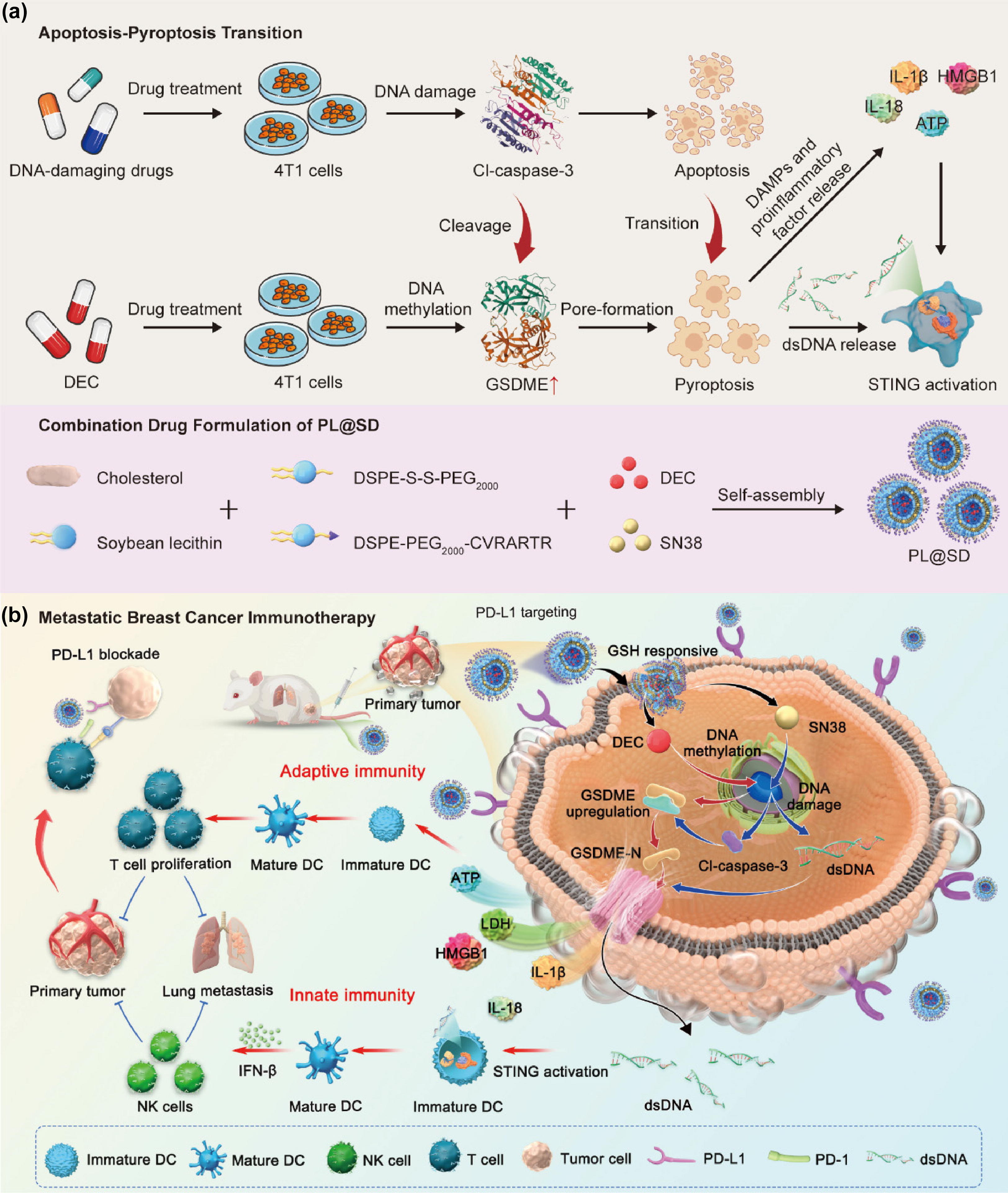
在乳腺癌癥免疫療法中,誘導Pyroposis的化學療法有望激活適應性免疫和先天免疫。然而,它們的實際療效往往受到焦亡性氣體皮蛋白表達不足和腫瘤衍生DNA轉移不足的限制。
鑒于此,新加坡國立大學陳小元、廣州醫科大學李仕穎、南方醫科大學成紅等人表明化療藥物引發的凋亡-焦亡轉變觸發轉移性乳腺癌癥免疫療法的適應性和先天免疫
研究結果表明,地西他濱(DEC)的表觀遺傳藥物可以提高癌癥細胞中的gasdermin E(GSDME)水平,而7-乙基-10-羥基喜樹堿(SN38)的DNA損傷化療藥物可以激活胱天蛋白酶-3和干擾素基因的環狀GMP-AMP合成酶刺激劑(cGAS-STING)通路。基于這些發現,進一步制備了配備PD-L1阻斷肽(PD-L1-pep)的谷胱甘肽(GSH)響應性納米平臺,用于將這些化療組合靶向遞送至癌癥細胞。
有趣的是,凋亡焦亡開關(表示為PL@SD)不僅能夠級聯激活半胱氨酸天冬氨酸蛋白酶-3和GSDME以誘導凋亡-焦亡轉變,而且通過孔形成加速腫瘤衍生DNA的釋放以引發cGAS STING活性。同時,PL@SD提高樹突狀細胞成熟、細胞毒性T淋巴細胞浸潤、自然殺傷細胞補充和長期免疫記憶效應,以增強適應性和先天免疫,從而協同抑制原發性乳腺癌癌癥、遠處肺轉移和腫瘤再激勵。總的來說,這項研究提出了一種復雜的凋亡-焦亡轉變和cGAS STING激活策略,這可能為擴大現有治療藥物在腫瘤免疫治療中的應用提供新的見解。
參考文獻:
Chemotherapeutics-enabled apoptosis-pyroptosis switch to trigger adaptive and innate immunity for metastatic breast cancer immunotherapy. Materials Today 2025.
https://doi.org/10.1016/j.mattod.2025.01.009


















