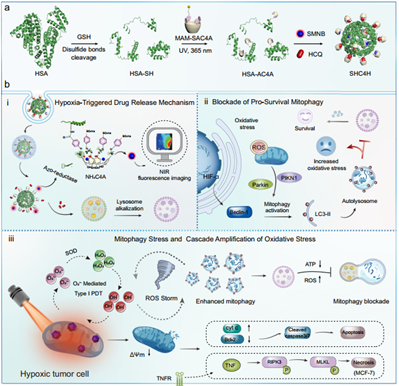
乏氧腫瘤具有適應低氧環境的能力,這種能力可支持腫瘤的生存和產生治療抗性,因此成為了癌癥治療面臨的一項嚴峻挑戰。增強的線粒體自噬(通過自噬選擇性降解線粒體)是幫助維持乏氧腫瘤細胞穩態的重要機制。有鑒于此,中山大學Hongzhong Chen、曾小偉教授和南開大學郭東升教授開發了偶氮杯[4]芳烴修飾的超分子白蛋白納米顆粒,其可共遞送羥氯喹和線粒體靶向光敏劑,進而能夠通過調節線粒體自噬誘導級聯氧化應激,以治療乏氧腫瘤。
本文要點:
(1)這些納米顆粒能夠響應乏氧,并在乏氧的腫瘤細胞中釋放負載的客體分子。研究發現,釋放的羥氯喹可破壞線粒體自噬過程,從而增加氧化應激,并進一步削弱腫瘤細胞。在激光照射下,光敏劑能夠產生不依賴于氧氣的活性氧,以誘導線粒體損傷和線粒體自噬激活。
(2)實驗結果表明,同步的時空自噬激活和自噬通量阻斷的雙重作用能夠實現增強的自噬和氧化應激,最終導致腫瘤細胞死亡。綜上所述,該研究證明了將羥氯喹介導的線粒體自噬阻斷與線粒體靶向光敏劑進行聯合能夠級聯放大氧化應激,以實現對乏氧腫瘤的有效治療。
Wenyan Wang. et al. Engineered hypoxia-responsive albumin nanoparticles mediating mitophagy regulation for cancer therapy. Nature Communications. 2025
https://www.nature.com/articles/s41467-025-55905-y



















