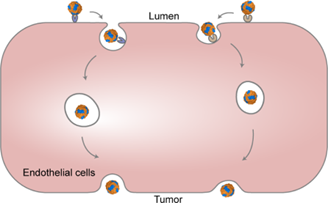
血管在藥物的全身遞送過程中具有屏障作用,由此導致設計雙靶向納米藥物以提高其腫瘤遞送效能成為了一項嚴峻的挑戰。如何實現有效的跨內皮細胞運輸是一個重要的研究課題。有鑒于此,南開大學莊潔教授和黃興祿教授報道了一種基于合成生物學、用于設計雙靶向鐵蛋白納米籠(Dt-FTn)的方法,以探究受體介導的跨腫瘤內皮細胞運輸過程。
本文要點:
(1)實驗利用基因工程化邏輯門控策略在大腸桿菌中共組裝了多種具有可調節的RGD靶向配體和固有TfR1靶向配體比例的Dt-FTn。這些Dt-FTn可用于研究在低滲透性腫瘤中受體介導的血管滲透性與雙靶向納米藥物之間的相互作用。基于機器學習的單血管分析結果顯示,雙受體表達譜會顯著影響雙靶向納米藥物在低滲透性腫瘤中的血管運輸過程。
(2)在患者源性結腸癌模型中,該納米藥物的雙配體最佳比例可以根據腫瘤細胞的受體表達譜實現定制。綜上所述,該研究能夠為合理設計用于腫瘤靶向遞送的雙靶向納米藥物提供新的見解和指導。
Mingsheng Zhu. et al. Rational Design of Dual-Targeted Nanomedicines for Enhanced Vascular Permeability in Low-Permeability Tumors. ACS Nano. 2025
DOI: 10.1021/acsnano.4c12808
https://pubs.acs.org/doi/10.1021/acsnano.4c12808



















