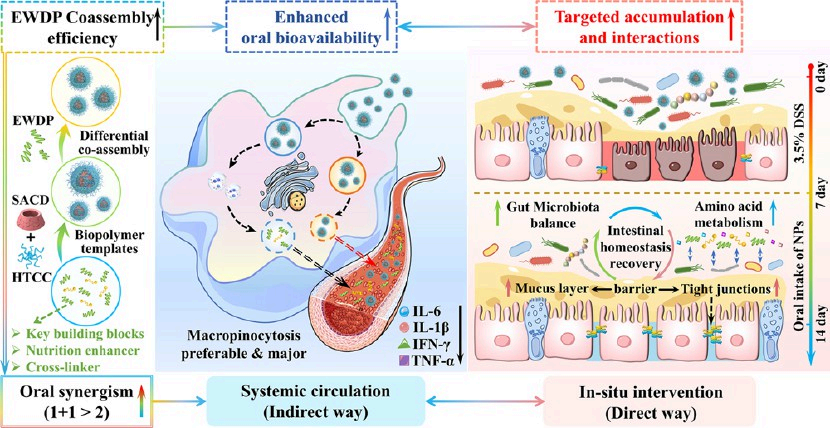
口服多種營養藥物的靶向納米策略具有優越的患者依從性、成本效益和生物相容性,其在潰瘍性結腸炎(UC)的治療領域中受到了越來越多的關注。然而,營養保健品的實際靶向遞送和生物功效仍會受到溶解度差以及胃腸道內滯留效果不佳等問題的限制。有鑒于此,吉林大學杜志陽教授開發了由季銨殼聚糖(HTCC)外殼和琥珀酸修飾的γ-環糊精(SACD)內核組成的可控結腸靶向納米顆粒(NPs),并將其用于實現對UC的精準治療。
本文要點:
(1)蛋清衍生肽(EWDP,典型的食物衍生肽)不僅可以作為潛在的交聯劑以誘導與上述生物聚合物的差異化共聚,還有助于改善疏水姜黃素(Cur)的溶解度和提高營養增強劑用于口服結腸炎治療的協同作用。研究發現,具有較高EWDP共組裝效率的NPs能夠表現出更好的對pH敏感的膠體可調性(例如,更小的尺寸,更高的剛性和粗糙度)和強大的營養保健品(EWDP/Cur)負載能力(24.0 ~ 33.2% >>10%,pH 2.0 ~ 7.0)。
(2)與純保健品相比,NPs可通過更快的粘液滲透和巨胞飲轉運表現出優異的細胞吸收增強(近10倍)和口服生物利用度改善(4.19 - 5.05倍),并間接調節全身炎癥反應。實驗結果表明,NPs的持續序貫釋放和靶向積累等特性可直接促進與結腸微環境的相互作用,并恢復腸道屏障和腸道微生物群。此外,氨基酸代謝的關鍵作用也再次證實了EWDP共組裝效率對于維持腸道穩態的重要性。綜上所述,該研究為程序化設計食源性肽(如EWDP)協同組裝納米平臺以實現對UC的口服靶向治療提供了一個新的方法。
Meng Yang. et al. Programmable Food-Derived Peptide Coassembly Strategies for Boosting Targeted Colitis Therapy by Enhancing Oral Bioavailability and Restoring Gut Microenvironment Homeostasis. ACS Nano. 2025
DOI: 10.1021/acsnano.4c11108
https://pubs.acs.org/doi/10.1021/acsnano.4c11108



















