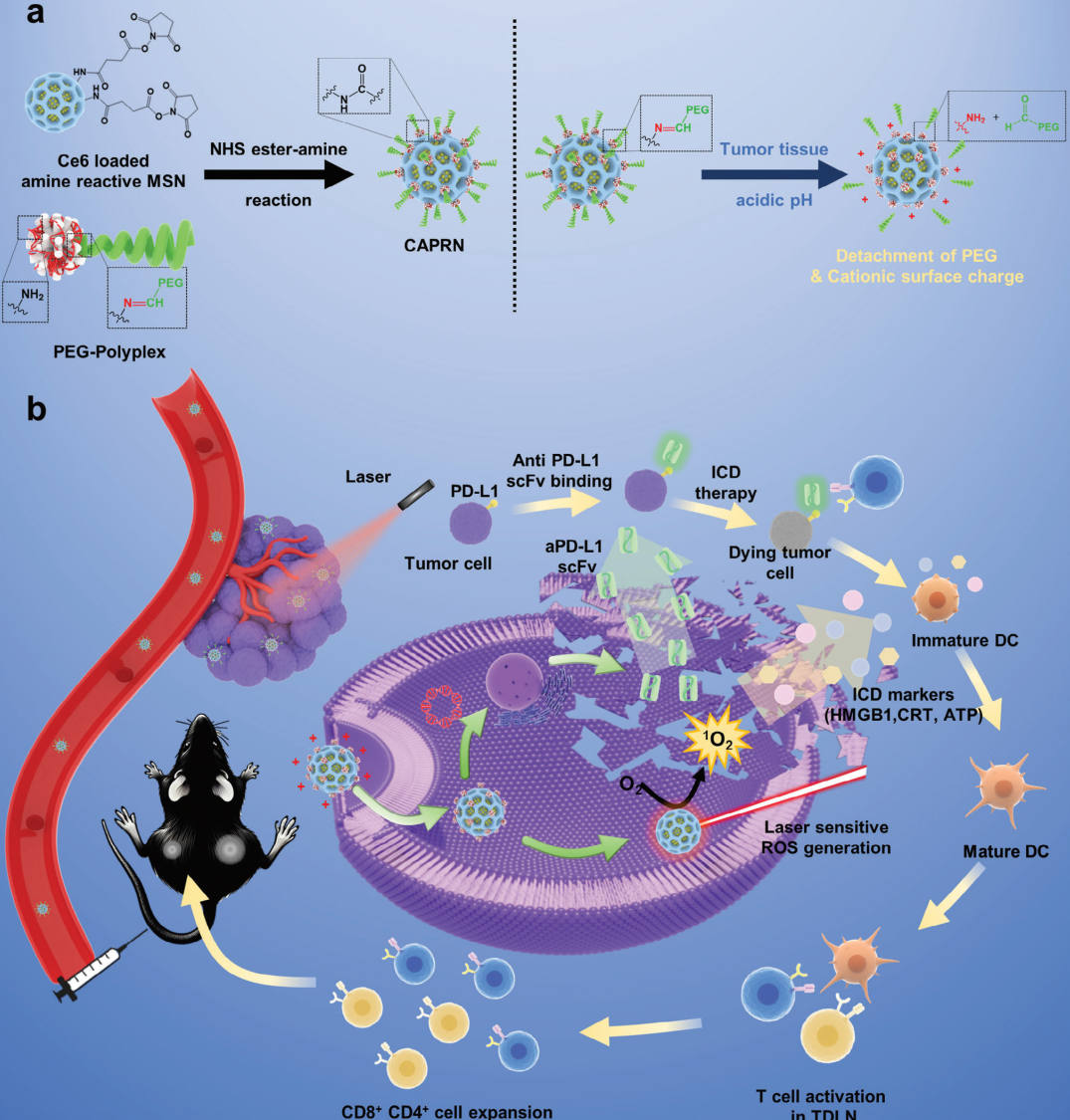
免疫療法,特別是免疫檢查點阻斷(ICB)療法,是腫瘤治療領域中的一次重要變革。然而,免疫療法目前也面臨著藥物積累不足以及對以缺乏T細胞浸潤和免疫抑制性微環(huán)境為主要特征的“冷”腫瘤的療效有限等挑戰(zhàn)。有鑒于此,浦項科技大學Won Jong Kim開發(fā)了一種能夠控制抗體產(chǎn)生和釋放的納米顆粒(CAPRN),旨在通過促進腫瘤靶向抗體的產(chǎn)生和誘導光動力細胞死亡來增強ICB的功效。
本文要點:
(1)CAPRN可通過pH響應性PEG分離實現(xiàn)腫瘤特異性積累,以促進編碼抗PD-L1抗體的高效胞內(nèi)基因遞送。激光誘導的光動力療法(PDT)不僅可以觸發(fā)癌細胞死亡,還可以促進垂死的腫瘤細胞釋放靶向抗體。研究發(fā)現(xiàn),CAPRN具有顯著的抗腫瘤功效,其產(chǎn)生的多重作用主要包括增強抗體釋放、樹突狀細胞(DC)成熟和T細胞活化。
(2)實驗結(jié)果表明,CAPRN能夠在原發(fā)性和雙側(cè)腫瘤模型中表現(xiàn)出顯著的腫瘤抑制作用,增強活化的T細胞浸潤和免疫應答。綜上所述,該研究開發(fā)了一種能夠啟動免疫治療的新策略,即通過激光輔助的光動力納米顆粒實現(xiàn)靶向抗體的釋放。
Mihyeon Park. et al. Nanoparticle-Mediated Explosive Anti-PD-L1 Factory Built in Tumor for Advanced Immunotherapy. Advanced Materials. 2025
DOI: 10.1002/adma.202417735
https://onlinelibrary.wiley.com/doi/10.1002/adma.202417735



















