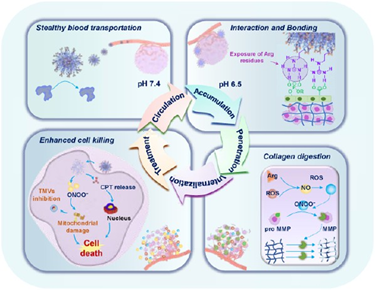
化療是胰腺癌的主要治療選擇。基于納米載體的藥物遞送系統(tǒng)往往會與多種生理障礙“作斗爭”,從而導(dǎo)致其治療效果受限。有鑒于此,華南理工大學(xué)袁友永教授開發(fā)了一種包封喜樹堿(CPT,胰腺化療藥物伊立替康(CPT-11)的類似物)、對pH/活性氧(ROS)雙重敏感的自適應(yīng)納米載體(DATCPT),其可通過解決多種生理障礙來提高原位胰腺癌的化療效果。
本文要點:
(1)該納米載體的特點是DATCPT外周具有帶正電的精氨酸(Arg)殘基,并被酸不穩(wěn)定的2,3-二甲基馬來酸酐(DA)掩蓋,以延長循環(huán)時間。在酸性腫瘤微環(huán)境(TME)中,DA會發(fā)生解離導(dǎo)致精氨酸暴露,以促進(jìn)納米載體結(jié)合和DATCPT的內(nèi)化。隨后,暴露的精氨酸和活性氧會通過級聯(lián)反應(yīng)產(chǎn)生過氧亞硝酸鹽(ONOO?),其可有效激活基質(zhì)金屬蛋白酶(MMPs)以降解致密的細(xì)胞外基質(zhì)(ECM),從而能夠增強(qiáng)DATCPT的深度積累和滲透。
(2)實驗結(jié)果表明,ONOO?可通過影響線粒體功能、阻止三磷酸腺苷(ATP)的產(chǎn)生和抑制ATP依賴性腫瘤源性微泡(TMVs)等機(jī)制抑制腫瘤轉(zhuǎn)移。綜上所述,該研究為開發(fā)有效的納米載體以解決抗胰腺癌治療面臨的多重生理障礙提供了一個新的策略。
Mengchao Ding. et al. Self-Adaptive Nanocarriers Overcome Multiple Physiological Barriers to Boosting Chemotherapy of Orthotopic Pancreatic Cancer. ACS Nano. 2025
DOI: 10.1021/acsnano.4c11514
https://pubs.acs.org/doi/10.1021/acsnano.4c11514



















