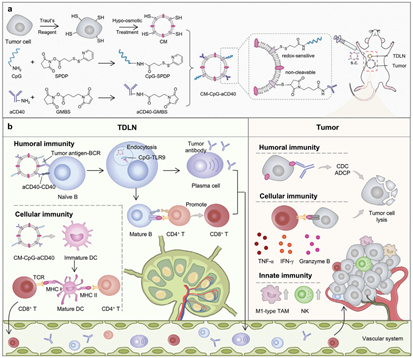
B淋巴細胞是一個重要的免疫調節靶點。接種腫瘤細胞膜衍生的疫苗能夠激活B細胞,但該策略的激活效率仍會因缺乏共刺激分子而受到限制。有鑒于此,中國科學院上海藥物研究所李亞平研究員和尹琦研究員將免疫刺激CpG寡核苷酸和抗CD40抗體(aCD40)偶聯到三陰性乳腺癌細胞源性膜囊泡上,構建了一種時空同步的抗原-佐劑整合納米疫苗CM-CpG-aCD40,并將其用于增強B細胞的抗腫瘤應答。
本文要點:
(1)CM-CpG-aCD40可在淋巴結中主動積累,并通過aCD40對CD40的識別而被抗原提呈細胞有效捕獲。CM-CpG-aCD40上的腫瘤抗原能夠與B細胞受體結合,從而為B細胞提供第一個刺激信號。與此同時,CpG/Toll樣受體與aCD40/CD40的相互作用能夠提供疊加的共刺激信號,以提高B細胞的抗體分泌和抗原提呈的能力。此外,該納米疫苗也能夠刺激樹突狀細胞,以激活CD8+ T細胞,并重編程腫瘤相關巨噬細胞。
(2)實驗結果表明,CM-CpG-aCD40可激活體液、細胞和先天抗腫瘤免疫,腫瘤抑制率為89.3%。與抗程序性死亡配體1(anti-programmed death ligand 1,PD-L1)抗體聯合后,CM-CpG-aCD40的腫瘤抑制率可進一步提升至95.4%。綜上所述,該研究構建的CM-CpG-aCD40是一種個性化多表位納米疫苗,能夠為實現基于B細胞的腫瘤免疫治療提供一個新的策略。
Wenlu Yan. et al. Personalized Multi-Epitope Nanovaccine Unlocks B Cell-Mediated Multiple Pathways of Antitumor Immunity. Advanced Materials. 2024
DOI: 10.1002/adma.202411361
https://onlinelibrary.wiley.com/doi/10.1002/adma.202411361



















