北京時間10月9日下午5點(diǎn)45分許,2024年諾貝爾化學(xué)獎揭曉。瑞典皇家科學(xué)院決定將2024年諾貝爾化學(xué)獎的一半授予大衛(wèi)·貝克(David Baker),以表彰他在“計算蛋白質(zhì)設(shè)計”方面的貢獻(xiàn),并將另一半授予戴密斯·哈薩比斯(Demis Hassabis)和約翰·M·詹伯(John M. Jumper),以表彰他們在“蛋白質(zhì)結(jié)構(gòu)預(yù)測”方面的貢獻(xiàn)。下面,我們主要介紹一下我們熟悉的來自華盛頓大學(xué)的David Baker近期的研究,供讀者閱讀~
1. Nature:設(shè)計的內(nèi)吞誘導(dǎo)蛋白降解靶標(biāo)并放大信號

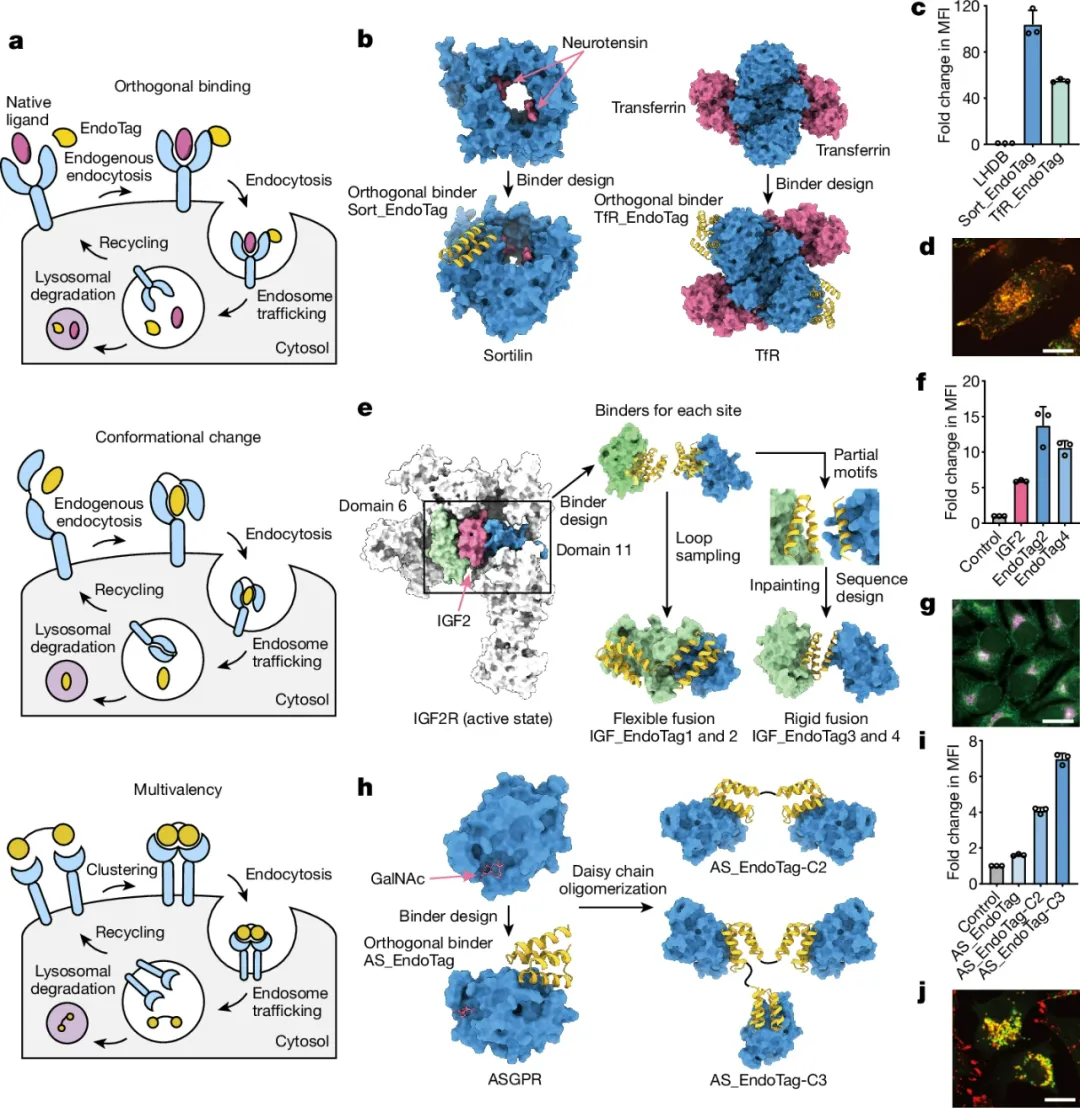
內(nèi)吞作用和細(xì)胞表面受體的溶酶體運(yùn)輸可以通過內(nèi)源性配體觸發(fā)。治療方法如溶酶體靶向嵌合體1,2(LYTACs)和細(xì)胞因子受體靶向嵌合體3(KineTACs)利用這一點(diǎn),通過將修改后的天然配體與目標(biāo)結(jié)合蛋白融合,來靶向特定蛋白質(zhì)進(jìn)行降解。盡管這些方法很強(qiáng)大,但它們可能受到與天然配體競爭的限制,以及化學(xué)修飾的要求,這些要求限制了遺傳編碼能力,并可能使制造過程復(fù)雜化,而且,更一般地說,可能沒有通過給定受體刺激內(nèi)吞作用的天然配體。
于此,華盛頓大學(xué)David Baker等人描述了針對內(nèi)吞觸發(fā)結(jié)合蛋白(EndoTags)的計算設(shè)計方法,這些方法克服了這些挑戰(zhàn)。
研究人員為胰島素樣生長因子2受體(IGF2R)和無唾液酸糖蛋白受體(ASGPR)、分選蛋白和轉(zhuǎn)鐵蛋白受體提出了EndoTags,并展示了將這些標(biāo)簽與可溶性或跨膜目標(biāo)蛋白結(jié)合物融合,可以導(dǎo)致溶酶體運(yùn)輸和目標(biāo)降解。由于這些受體在不同組織中的分布不同,不同的EndoTags可以實(shí)現(xiàn)對不同組織的降解靶向。與PD-L1抗體融合的EndoTag在小鼠腫瘤模型中的療效顯著高于單獨(dú)的抗體。
EndoTags的模塊化和遺傳編碼能力實(shí)現(xiàn)了更高特異性靶向降解的AND門控制,以及從工程細(xì)胞中局部分泌降解劑。通過促進(jìn)內(nèi)吞作用,EndoTag融合通過近100倍的信號增強(qiáng),通過工程配體-受體系統(tǒng)。EndoTags作為靶向降解誘導(dǎo)劑、內(nèi)吞依賴途徑的信號激活劑以及靶向抗體-藥物和抗體-RNA偶聯(lián)物的細(xì)胞攝取誘導(dǎo)劑具有相當(dāng)大的治療潛力。
參考文獻(xiàn):
Huang, B., Abedi, M., Ahn, G. et al. Designed endocytosis-inducing proteins degrade targets and amplify signals. Nature (2024).
https://doi.org/10.1038/s41586-024-07948-2
2. Nature:使用深度學(xué)習(xí)從頭設(shè)計螢光素酶

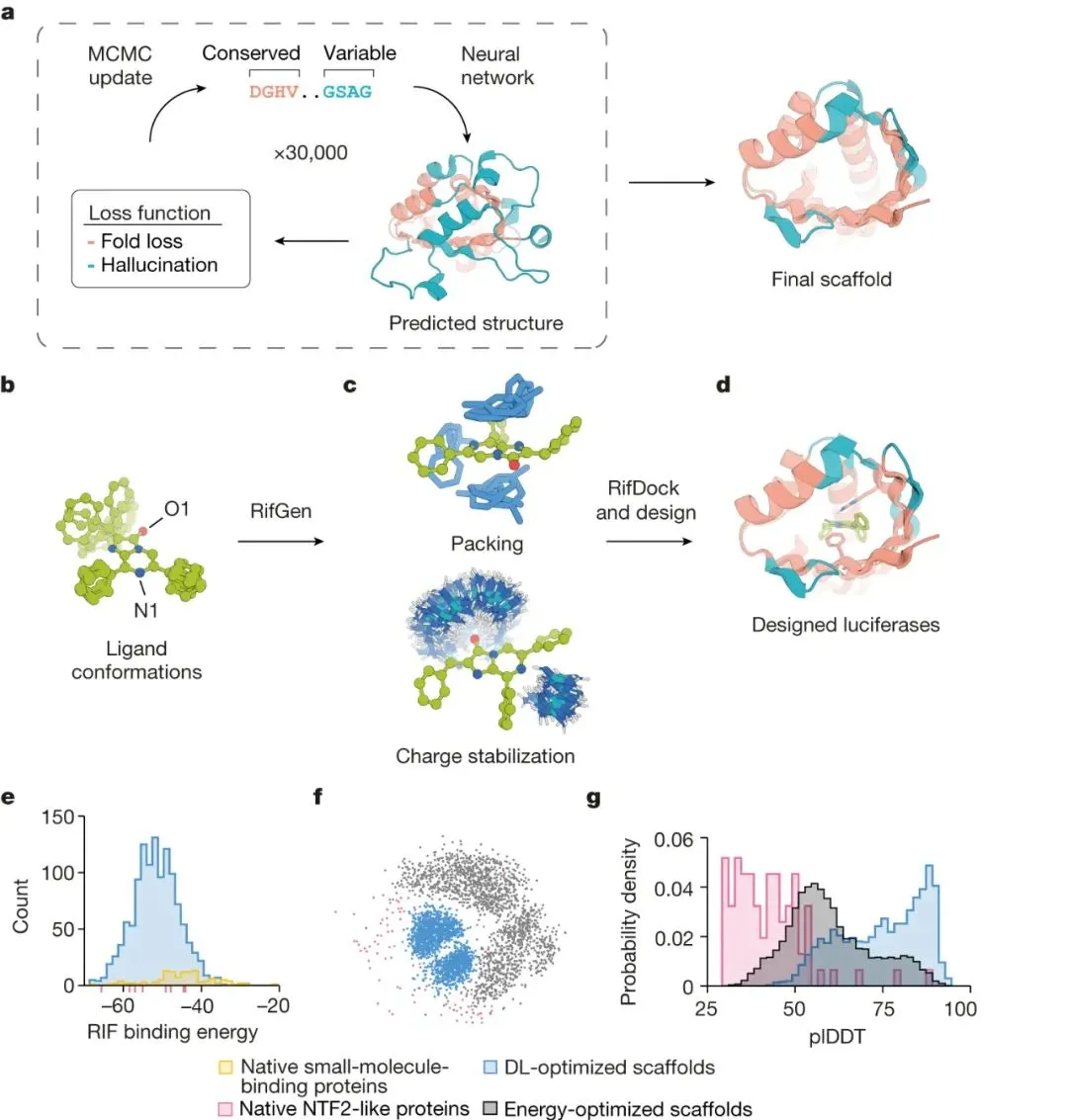
熒光素酶作為分子探針的開發(fā)落后于發(fā)達(dá)的熒光蛋白工具包,原因有很多:(i)很少發(fā)現(xiàn)天然熒光素素酶;(ii)許多已鑒定的那些需要多個二硫鍵來穩(wěn)定結(jié)構(gòu),因此容易在哺乳動物細(xì)胞中發(fā)生錯誤折疊;(iii)大多數(shù)天然螢光素酶不識別具有更理想的光物理性質(zhì)的合成螢光素;(iv)使用相互正交的熒光素酶-熒光素對并行進(jìn)行多個過程的多重成像受到天然熒光素酶底物特異性低的限制。
為了克服這些局限性,華盛頓大學(xué)David Baker、Andy Hsien-Wei Yeh等人試圖使用基于“family-wide hallucination”方法從頭蛋白質(zhì)設(shè)計來產(chǎn)生小的、高度穩(wěn)定的、在細(xì)胞中表達(dá)良好的、對一種底物具有特異性且不需要輔因子發(fā)揮作用的熒光素酶。研究人員選擇了一種合成的熒光素二苯噻嗪(DTZ)作為靶底物,因為它具有高量子產(chǎn)率、紅移發(fā)射、有利的體內(nèi)藥代動力學(xué)以及缺乏發(fā)光所需的輔因子。
Yeh, A.HW., Norn, C., Kipnis, Y. et al. De novo design of luciferases using deep learning. Nature 614, 774–780 (2023).
https://doi.org/10.1038/s41586-023-05696-3
3. Nature Nanotechnology:pH響應(yīng)自組裝螺旋蛋白絲的從頭設(shè)計

華盛頓大學(xué)David Baker、Hao Shen等研究人員描述了一種全新的pH響應(yīng)性蛋白纖維的設(shè)計。這些纖維由含有六個或九個埋藏組氨酸殘基的亞基組成,在中性pH下組裝成微米尺度的有序纖維。通過冷凍電子顯微鏡(cryo-EM)確定了優(yōu)化設(shè)計的結(jié)構(gòu),其與計算設(shè)計模型幾乎一致,無論是亞基內(nèi)部幾何形狀還是亞基在纖維中的堆積方式。
研究人員通過計算設(shè)計方法成功創(chuàng)造了能夠在特定pH變化下自組裝和解組裝的蛋白纖維。他們設(shè)計了含有多個埋藏組氨酸殘基的亞基,這些殘基在pH變化時改變其質(zhì)子化狀態(tài),從而觸發(fā)纖維的組裝和解組裝。通過篩選和表達(dá)18個不同的設(shè)計,研究人員發(fā)現(xiàn)DpHF7和DpHF18能夠在降低pH值時解組裝,并在pH值回升時重新組裝,展示了對pH變化的敏感和可調(diào)節(jié)的響應(yīng)性。
Shen, H., Lynch, E.M., Akkineni, S. et al. De novo design of pH-responsive self-assembling helical protein filaments. Nat. Nanotechnol. (2024).
https://doi.org/10.1038/s41565-024-01641-1
4. Nature Biotechnology:新型生物傳感器!
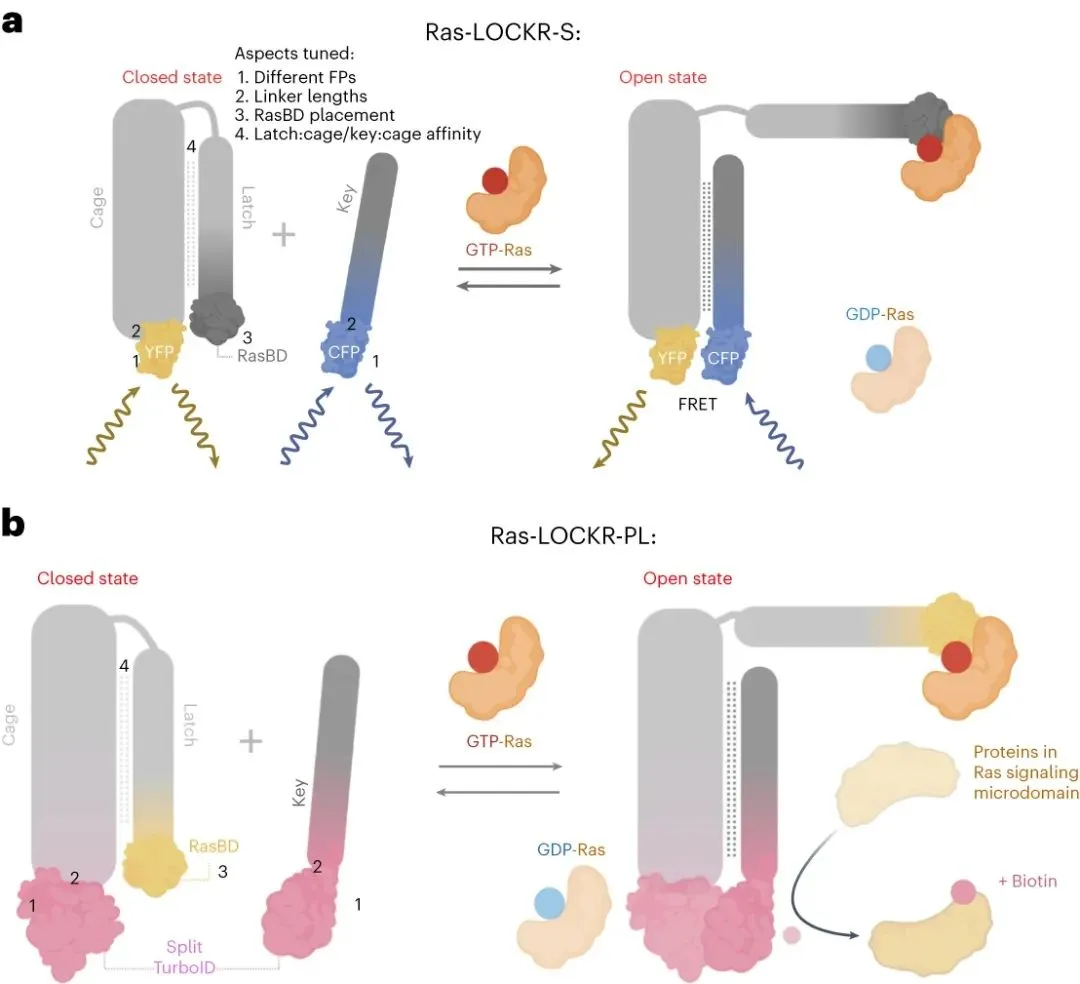
為了開發(fā)內(nèi)源性活性Ras的傳感器,華盛頓大學(xué)David Baker、Dustin J. Maly、Jason Z. Zhang等研究人員使用了新的傳感器支架和設(shè)計方法。
對于傳感器支架,研究人員使用了從頭蛋白質(zhì)開關(guān)LOCKR(閂鎖正交籠鍵蛋白質(zhì))。LOCKR與天然蛋白質(zhì)沒有序列或結(jié)構(gòu)相似性。此外,它的切換行為是清晰的,并且由于它的正交性,它可以在不影響傳感器功能的情況下發(fā)生變化。
對于設(shè)計方法,研究人員使用基于Rosetta的蛋白質(zhì)設(shè)計算法和AlphaFold結(jié)構(gòu)預(yù)測來調(diào)整LOCKR的切換(從閉合的、自動抑制的狀態(tài)轉(zhuǎn)變?yōu)镽as-GTP依賴的開放狀態(tài),其中讀出結(jié)構(gòu)域接近),以匹配內(nèi)源性活性Ras的生理相關(guān)濃度范圍。利用這些策略,研究人員開發(fā)了兩種傳感器:一種是基于熒光的傳感器,該傳感器基于距離依賴性F?rster共振能量轉(zhuǎn)移的變化來測量Ras的活性(命名為Ras-LOCKR-S),另一種是通過生物素化活性Ras周圍的附近蛋白質(zhì)來表征Ras環(huán)境的基于分裂鄰近標(biāo)記器的傳感器(命名為Ras-LOCKR-PL)。這些傳感器足夠靈敏以檢測內(nèi)源性活性Ras,與活細(xì)胞兼容以使Ras活性能夠隨時間測量,并且可以定位于不同的細(xì)胞區(qū)室以使Ras-GTP能夠以亞細(xì)胞分辨率檢測。
Zhang, J.Z., Nguyen, W.H., Greenwood, N. et al. Computationally designed sensors detect endogenous Ras activity and signaling effectors at subcellular resolution. Nat Biotechnol (2024).
https://doi.org/10.1038/s41587-023-02107-w
5. Nature Chemistry:由可延伸蛋白質(zhì)復(fù)合物制成的精確圖案化納米纖維

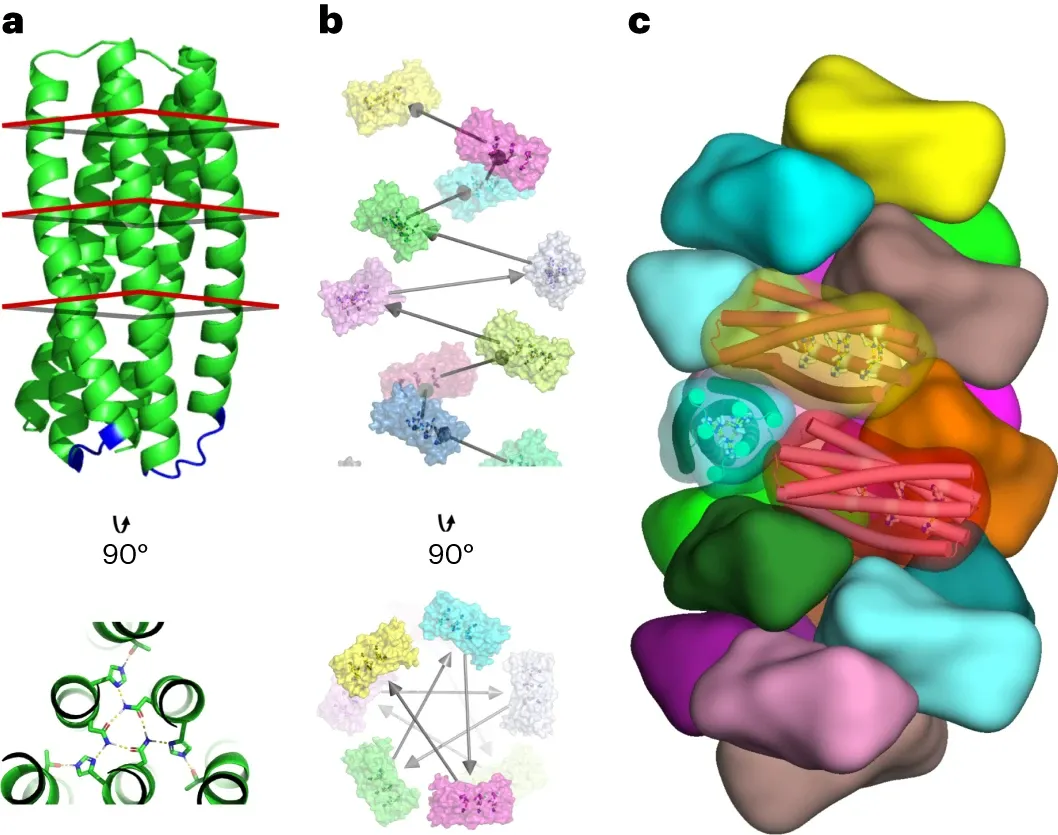
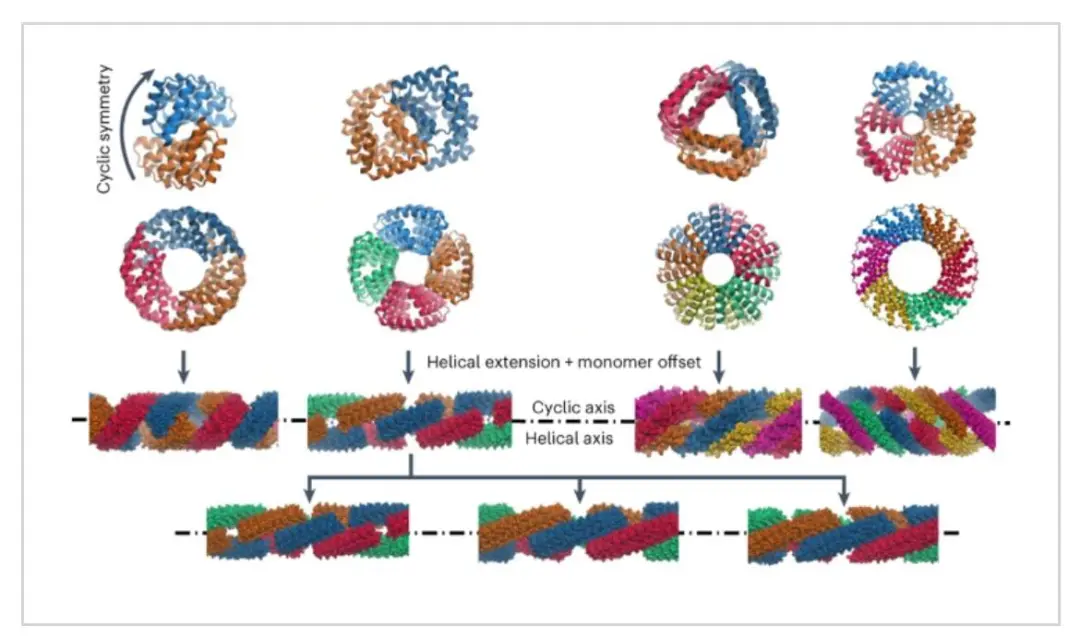
具有環(huán)狀和超螺旋對稱軸的分子系統(tǒng)在材料設(shè)計方面具有巨大優(yōu)勢,因為它們可以通過改變組成單體的長度來延長或縮短。在蛋白質(zhì)中,α螺旋盤繞線圈具有對稱、可擴(kuò)展的結(jié)構(gòu),但其受到螺旋原聚體相對固定的幾何形狀和柔性的限制。在這里,華盛頓大學(xué)David Baker報道了由可延伸蛋白質(zhì)復(fù)合物制成的精確圖案化納米纖維。
作者描述了一種產(chǎn)生具有重合C2至C8和超螺旋對稱軸的模塊化和剛性重復(fù)蛋白質(zhì)低聚物的方法,該低聚物可以通過重復(fù)傳播進(jìn)行擴(kuò)展。
在這些構(gòu)建塊中,作者發(fā)現(xiàn)可以通過引入親水性表面片段來系統(tǒng)設(shè)計各種無界纖維,從而迫使單體發(fā)生交錯。這種纖維的幾何形狀可以通過改變單體中重復(fù)單元的數(shù)量和親水性片段的位置來精確調(diào)節(jié)。
參考文獻(xiàn):
Neville P. Bethel et.al Precisely patterned nanofibres made from extendable protein multiplexes Nature Chemistry 2023
DOI: 10.1038/s41557-023-01314-x
https://doi.org/10.1038/s41557-023-01314-x
6. Nature Materials:三維蛋白質(zhì)晶體的精確計算設(shè)計

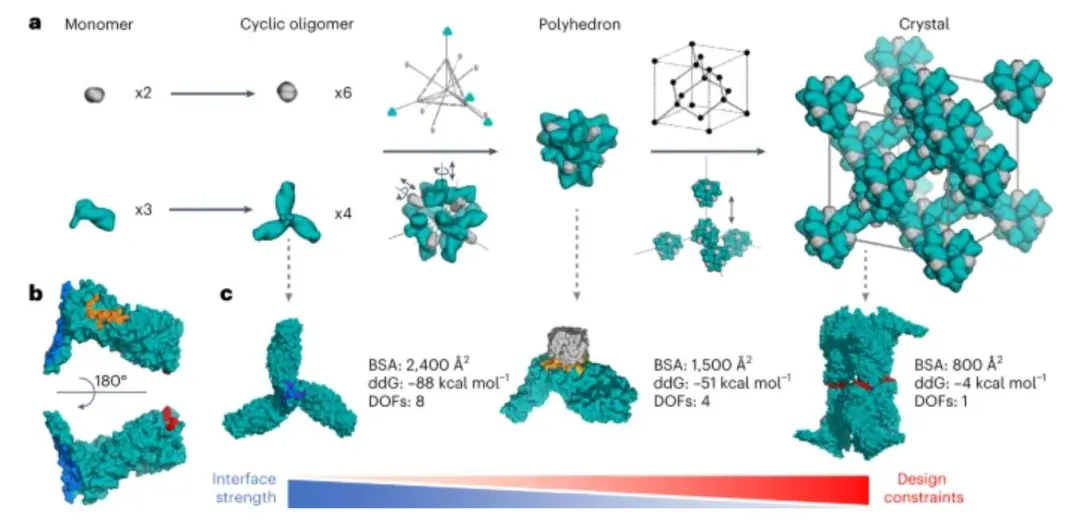
通過蛋白質(zhì)-蛋白質(zhì)界面上精確設(shè)計的側(cè)鏈-側(cè)鏈相互作用來編程蛋白質(zhì)結(jié)晶極具挑戰(zhàn)性。在這里,華盛頓大學(xué)David Baker開發(fā)了一種通用的計算方法,用于以原子精度設(shè)計具有預(yù)先指定的晶格結(jié)構(gòu)的三維蛋白質(zhì)晶體。
作者設(shè)計了三對低聚物,它們可以單獨(dú)純化,混合后自發(fā)地自組裝成>100?μm三維晶體。這些晶體的結(jié)構(gòu)與計算設(shè)計模型幾乎相同,在整體結(jié)構(gòu)和特定的蛋白質(zhì)-蛋白質(zhì)相互作用方面都非常對應(yīng)。
晶體晶胞的尺寸可以被系統(tǒng)地重新設(shè)計,同時保持空間群對稱性和整體結(jié)構(gòu),晶體具有極高的多孔性和高度穩(wěn)定性。該方法能夠高精度地進(jìn)行蛋白質(zhì)晶體的計算設(shè)計,所設(shè)計的蛋白質(zhì)晶體在其初級序列中編碼了結(jié)構(gòu)和組裝信息,為生物材料工程提供了強(qiáng)大的平臺。
參考文獻(xiàn):
Zhe Li et.al Accurate computational design of three-dimensional protein crystals Nature Materials 2023
DOI: 10.1038/s41563-023-01683-1
https://doi.org/10.1038/s41563-023-01683-1
7. Science:可靈活設(shè)計的對稱性蛋白質(zhì)組裝

幾乎在所有的生物過程中,環(huán)狀蛋白質(zhì)低聚物都起著關(guān)鍵性的作用,它們占蛋白質(zhì)數(shù)據(jù)庫(PDB)中所有解析結(jié)構(gòu)的近30%。環(huán)狀蛋白質(zhì)低聚物具有較為廣泛的應(yīng)用,從小分子結(jié)合和催化到納米級組裝的構(gòu)建等。自蛋白質(zhì)設(shè)計領(lǐng)域取得突破以來,這種環(huán)狀蛋白結(jié)構(gòu)的自主設(shè)計一直備受關(guān)注,然而目前的方法均需要事先對單體的結(jié)構(gòu)進(jìn)行規(guī)范化,除了參數(shù)化設(shè)計的螺旋束外,還涉及將先前表征的單體剛性對接到高階對稱結(jié)構(gòu)中,然后才能進(jìn)行界面優(yōu)化,以將低能量傳遞給組裝狀態(tài)。近年來,深度學(xué)習(xí)的方法為進(jìn)一步廣泛探索天然蛋白質(zhì)序列和結(jié)構(gòu)之外的蛋白質(zhì)結(jié)構(gòu)提供了極大空間。
最近,來自華盛頓大學(xué)生物化學(xué)系的D. Baker等人使用深度網(wǎng)絡(luò)學(xué)習(xí)來生成范圍極廣的對稱性蛋白質(zhì)同源寡聚體,且只需指定原聚體的數(shù)量和原聚體長度即可實(shí)現(xiàn)。
該研究設(shè)計了七種晶體結(jié)構(gòu)、以及三種具有1550個殘基和C33對稱性的巨型納米環(huán)(10 nm)的低溫電子顯微鏡結(jié)構(gòu)均與計算模型非常相似(中位均方根偏差:0.6埃);
研究者得到的所有這些環(huán)形蛋白組裝體都與現(xiàn)有已知的的結(jié)構(gòu)有較大不同,該結(jié)果表面通過深度學(xué)習(xí)可以為生成具有豐富結(jié)構(gòu)的新蛋白質(zhì)組裝體或納米機(jī)器結(jié)構(gòu)提供可能。

Baker D., et al. Hallucinating symmetric protein assemblies. Science. (2022).
DOI: 10.1126/science.add1964
https://www.science.org/doi/10.1126/science.add1964
8. Science:通過隱式負(fù)設(shè)計生成可重構(gòu)的不對稱蛋白質(zhì)組件
經(jīng)歷亞基交換的不對稱多蛋白復(fù)合物在生物學(xué)中發(fā)揮著核心作用,但也給設(shè)計帶來了挑戰(zhàn),因為這些組分不僅必須包含能夠?qū)崿F(xiàn)可逆結(jié)合的界面,而且還必須在隔離時保持穩(wěn)定和良好的性能。有鑒于此,美國華盛頓大學(xué)的David Baker等研究人員,通過隱式負(fù)設(shè)計生成可重構(gòu)的不對稱蛋白質(zhì)組件。
研究人員使用隱式負(fù)設(shè)計來生成可以組裝成多種復(fù)合物的 β 折疊介導(dǎo)的異二聚體。
這些設(shè)計是穩(wěn)定的、折疊的、可單獨(dú)溶解的,在混合時能快速組裝,并且晶體結(jié)構(gòu)接近計算模型。
研究人員構(gòu)建了具有多達(dá)六種不同組分的線性排列的異質(zhì)低聚物,支化的異質(zhì)低聚物,閉合的 C4 對稱雙組分環(huán),以及組裝在環(huán)狀同質(zhì)低聚物中心樞紐上的異質(zhì)低聚物,并證明這種復(fù)合物可以通過亞基交換重新配置。
本文研究的方法為設(shè)計不對稱的可重構(gòu)蛋白質(zhì)系統(tǒng)提供了一般的路線。

參考文獻(xiàn):
Danny D. Sahtoe, et al. Reconfigurable asymmetric protein assemblies through implicit negative design. Science, 2022.
DOI:10.1126/science.abj7662
https://www.science.org/doi/10.1126/science.abj7662
9. Nature:有利于簡化蛋白質(zhì)結(jié)合蛋白的設(shè)計過程的新方法
除了目標(biāo)三維結(jié)構(gòu)之外,不使用其他信息設(shè)計與目標(biāo)蛋白表面特定位點(diǎn)結(jié)合的蛋白質(zhì)仍具有挑戰(zhàn)性。有鑒于此,美國華盛頓大學(xué)的David Baker等研究人員,僅使用目標(biāo)結(jié)構(gòu)設(shè)計蛋白質(zhì)結(jié)合蛋白。
研究人員提出了一種解決蛋白設(shè)計的方案,首先對蛋白質(zhì)表面選定區(qū)域可能結(jié)合模式的大空間進(jìn)行廣泛探索,然后在最有希望的結(jié)合模式附近加強(qiáng)搜索。研究人員通過從頭設(shè)計將蛋白質(zhì)與12種不同形狀和表面特性的蛋白質(zhì)靶標(biāo)結(jié)合,證明了其具有廣泛的適用性。
生物物理特性表明,所有小于65個氨基酸的結(jié)合劑是超穩(wěn)定的,并且經(jīng)過實(shí)驗優(yōu)化后,它們可與靶標(biāo)蛋白以納摩爾到皮摩爾的親和力結(jié)合。研究人員成功解析了五種結(jié)合劑-靶標(biāo)配合物的晶體結(jié)構(gòu),這五種結(jié)構(gòu)都非常接近相應(yīng)的計算設(shè)計模型。
近50萬個計算設(shè)計和數(shù)十萬個點(diǎn)突變體的實(shí)驗數(shù)據(jù)提供了有關(guān)該方法優(yōu)勢、局限性以及對目前蛋白質(zhì)-蛋白質(zhì)相互作用理解的詳細(xì)反饋,并可用于對這兩種方法進(jìn)行改進(jìn)。
本文研究的方法可對治療和診斷應(yīng)用中各種蛋白質(zhì)上的感興趣位點(diǎn)進(jìn)行針對性設(shè)計。

參考文獻(xiàn):
Longxing Cao, et al. Design of protein binding proteins from target structure alone. Nature, 2022.
DOI:10.1038/s41586-022-04654-9
https://www.nature.com/articles/s41586-022-04654-9











